Eine kovalente Bindung tritt zwischen den beiden Nichtmetallen auf, eine metallische Bindung tritt zwischen zwei Metallen auf und die Ionenbindung tritt zwischen dem Metall und dem Nichtmetall auf. Kovalente Bindungen beinhalten das Teilen von Elektronen, während metallische Bindungen starke Anziehungskräfte aufweisen und ionische Bindungen das Übertragen und Akzeptieren von Elektronen von der Valenzhülle beinhalten.
Die anhaftende Eigenschaft eines Atoms, um sich durch Füllen der äußersten Elektronenbahn in einem möglichst stabilen Muster anzuordnen. Diese Assoziation von Atomen bildet die Moleküle, Ionen oder Kristalle und wird als chemische Bindung bezeichnet.
Aufgrund ihrer Stärke gibt es zwei Kategorien chemischer Bindungen: primäre oder starke Bindungen und sekundäre oder schwache Bindungen. Primärbindungen sind kovalente, metallische und ionische Bindungen, während Sekundärbindungen Dipol-Dipol-Wechselwirkungen, Wasserstoffbindungen usw. sind.
Nach der Einführung der Quantenmechanik und der Elektronen wurde im 20. Jahrhundert die Idee der chemischen Bindung entwickelt. Mit der Diskussion über die chemische Bindung kann man das Molekül kennenlernen. Die Moleküle sind die kleinste Einheit der Verbindung und geben Auskunft über die Verbindungen.
Um den Unterschied zwischen den drei Arten von Anleihen hervorzuheben, werden wir ihre Natur anhand einer kurzen Beschreibung überprüfen.
Vergleichstabelle
| Vergleichsbasis | Kovalente Bindung | Metallische Bindung | Ionenverbindung |
|---|---|---|---|
| Bedeutung | Wenn zwischen zwei positiv geladenen Kernen und dem gemeinsamen Elektronenpaar eine starke elektrostatische Anziehungskraft besteht, spricht man von einer kovalenten Bindung. | Wenn die starke elektrostatische Kraft der Anziehungskräfte zwischen dem Kation oder den Atomen und den delokalisierten Elektronen in der geometrischen Anordnung der beiden Metalle vorhanden ist, spricht man von einer metallischen Bindung. | Wenn zwischen einem Kation und einem Anion (zwei entgegengesetzt geladene Ionen) von Elementen eine starke elektrostatische Anziehungskraft besteht, spricht man von einer Ionenbindung. Diese Bindung wird zwischen einem Metall und einem Nichtmetall gebildet. |
| Existenz | Bestehen als Feststoffe, Flüssigkeiten und Gase. | Existiert nur im festen Zustand. | Sie existieren auch nur im festen Zustand. |
| Tritt zwischen auf | Zwischen zwei Nichtmetallen. | Zwischen zwei Metallen. | Nichtmetall und Metall. |
| Bezieht ein | Teilen von Elektronen in der Valenzschale. | Die Anziehungskraft zwischen den delokalisierten Elektronen im Gitter der Metalle. | Übertragung und Aufnahme von Elektronen aus der Valenzschale. |
| Leitfähigkeit | Sehr geringe Leitfähigkeit. | Hohe thermische und elektrische Leitfähigkeit. | Geringe Leitfähigkeit. |
| Härte | Diese sind nicht sehr hart, Ausnahmen sind jedoch Silizium, Diamant und Kohlenstoff. | Das ist nicht schwer. | Diese sind aufgrund der kristallinen Natur hart. |
| Schmelz- und Siedepunkte | Niedrig. | Hoch. | Höher. |
| Formbarkeit und Duktilität | Diese sind nicht formbar und nicht duktil. | Metallbindungen sind formbar und duktil. | Ionenbindungen sind auch nicht formbar und nicht duktil. |
| Bindung | Sie sind die Richtungsbindung. | Die Bindung ist ungerichtet. | Nichtrichtungs. |
| Bindungsenergie | Höher als die Metallbindung. | Niedriger als die beiden anderen Bindungen. | Höher als die Metallbindung. |
| Elektronegativität | Polarkovalent: 0, 5-1, 7; Unpolar <0, 5. | Nicht verfügbar. | > 1.7. |
| Beispiele | Diamant, Kohlenstoff, Kieselsäure, Wasserstoffgas, Wasser, Stickstoffgas usw. | Silber, Gold, Nickel, Kupfer, Eisen usw. | NaCl, BeO, LiF usw. |
Definition Kovalente Anleihen
Die kovalente Bindung wird in einem Element beobachtet, das rechts vom Periodensystem liegt und nichtmetallisch ist. Bei kovalenten Bindungen werden die Elektronen zwischen den Atomen geteilt. Die Paarung des gemeinsamen Elektrons erzeugt eine neue Umlaufbahn um die Kerne beider Atome, die als Molekül bezeichnet werden.
Es gibt starke elektrostatische Anziehungskräfte zwischen den beiden Kernen eines Atoms und die Bindung entsteht, wenn die Gesamtenergie während der Bindung niedriger ist als die Energie, die früher als einzelne Atome oder nahegelegene elektronegative Werte lag.
Die kovalenten Bindungen werden auch als molekulare Bindungen bezeichnet. Stickstoff (N2), Wasserstoff (H2), Wasser (H2O), Ammoniak (NH3), Chlor (Cl2), Fluor (F2) sind einige Beispiele für Verbindungen mit kovalenten Bindungen. Durch das Teilen von Elektronen können die Atome die stabile Konfiguration der äußeren Elektronenhülle erhalten.
Es gibt zwei Arten von kovalenten Bindungen, polare und unpolare . Diese Aufteilung basiert auf der Elektronegativität, da bei unpolaren Bindungen die Atome die gleiche Anzahl von Elektronen teilen, da die Atome identisch sind und die Elektronegativitätsdifferenz weniger als 0, 4 beträgt.
Zum Beispiel Wasser mit der Formel H2O, wobei die kovalente Bindung zwischen jedem Wasserstoff- und Sauerstoffmolekül besteht, wobei zwei Elektronen zwischen Wasserstoff und Sauerstoff geteilt werden, jeweils eines von jedem.
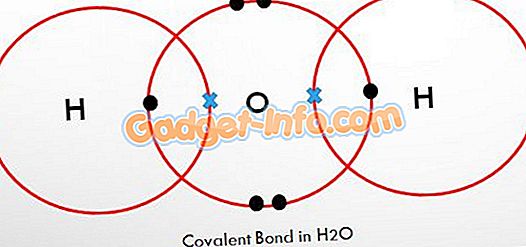
Als Wasserstoffmolekül enthält H2 zwei Wasserstoffatome, die durch die kovalente Bindung mit Sauerstoff verbunden sind. Dies sind die Anziehungskräfte zwischen den Atomen, die in der äußersten Umlaufbahn der Elektronen auftreten.
Definition von Metallbindungen
Die Art der chemischen Bindung, die zwischen den Metallen, Metalloiden und Legierungen gebildet wird. Die Bindung wird zwischen den positiv geladenen Atomen gebildet, wobei die gemeinsame Nutzung von Elektronen in den Strukturen von Kationen stattfindet. Diese gelten als gute Wärme- und Stromleiter.
Bei diesem Typ bewegen sich die Valenzelektronen kontinuierlich von einem Atom zum anderen, da die äußerste Elektronenhülle jedes Metallatoms die benachbarten Atome überlappt. Wir können also sagen, dass sich die Valenzelektronen im Metall kontinuierlich unabhängig von einem Ort zum anderen im gesamten Raum bewegen.
Aufgrund des Vorhandenseins der delokalisierten oder freien Elektronen der Valenzelektronen kam Paul Drude 1900 auf den Namen „ Elektronenmeer “. Die verschiedenen Eigenschaften der Metalle sind: Sie haben hohe Schmelz- und Siedepunkte, sind formbar und duktil, haben gute elektrische Leiter, starke metallische Bindungen und eine geringe Flüchtigkeit.
Definition von Ionenbindungen
Ionenbindungen sind definiert als die Bindungen zwischen dem positiven und dem negativen Ion mit der starken elektrostatischen Anziehungskraft . Ionenbindungen werden auch als elektrovalente Bindung bezeichnet. Das Atom, das ein oder mehrere Elektronen gewinnt oder verliert, wird als Ion bezeichnet. Das Atom, das die Elektronen verliert, erreicht die positive Ladung und wird als positives Ion bezeichnet, während das Atom, das die Elektronen gewinnt, die negative Ladung erreicht und als negatives Ion bezeichnet wird.
Bei dieser Art der Bindung werden die positiven Ionen zu den negativen Ionen und die negativen Ionen zu den positiven Ionen angezogen. Wir können also sagen, dass sich entgegengesetzte Ionen gegenseitig anziehen und wie Ionen abstoßen. Die entgegengesetzten Ionen ziehen sich also an und bilden aufgrund des Vorhandenseins einer elektrostatischen Anziehungskraft zwischen den Ionen die Ionenbindung.
Die Metalle in der äußersten Umlaufbahn haben nur wenige Elektronen, daher erreicht das Metall durch den Verlust solcher Elektronen die Edelgaskonfiguration und erfüllt somit die Oktettregel. Andererseits hat die Valenzschale von Nichtmetallen nur 8 Elektronen und erreicht daher durch Akzeptieren der Elektronen eine Edelgaskonfiguration. Die gesamte Nettoladung in der Ionenbindung muss Null sein . Die Akzeptanz oder Abgabe der Elektronen kann mehr als 1 betragen, um die Oktettregel zu erfüllen.
Nehmen wir das vorherrschende Beispiel des Natriumchlorids (NaCl), bei dem die äußerste Umlaufbahn des Natriums ein Elektron hat, während Chlor sieben Elektronen in der äußersten Hülle hat.
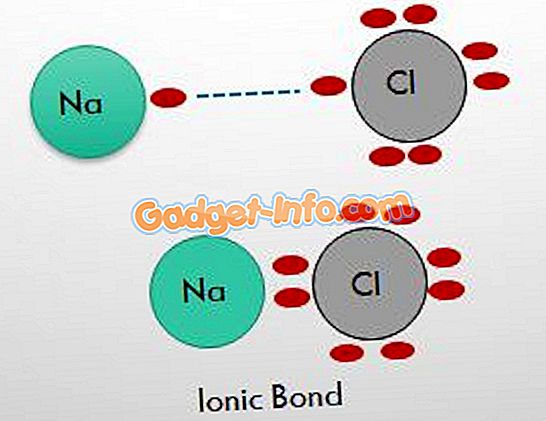
Chlor benötigt also nur ein Elektron, um sein Oktett zu vervollständigen. Wenn die beiden Atome (Na und Cl) nahe beieinander liegen, gibt das Natrium sein Elektron an Chlor ab. Durch den Verlust eines Elektrons wird Natrium positiv geladen und durch die Aufnahme eines Elektrons wird Chlor negativ geladen und wird zu einem Chloridion.
Hauptunterschiede zwischen kovalenten, metallischen und ionischen Bindungen
Nachstehend sind die Punkte aufgeführt, die zwischen den drei Arten starker oder primärer Bindungen unterscheiden:
- Kovalente Bindungen können gesagt werden, wenn die starke elektrostatische Anziehungskraft zwischen zwei positiv geladenen Kernen und dem gemeinsamen Elektronenpaar besteht. Während metallische Bindungen die starke elektrostatische Anziehungskraft zwischen dem Kation oder den Atomen und den delokalisierten Elektronen in der geometrischen Anordnung der beiden Metalle aufweisen. Wenn zwischen einem Kation und einem Anion (zwei entgegengesetzt geladene Ionen) von Elementen eine starke elektrostatische Anziehungskraft besteht, spricht man von einer Ionenbindung und wird zwischen einem Metall und einem Nichtmetall gebildet.
- Kovalente Bindungen existieren als Feststoffe, Flüssigkeiten und Gase, metallische Bindungen und ionische Bindungen existieren nur im festen Zustand.
- Kovalente Bindungen treten zwischen zwei Nichtmetallen auf, metallische Bindungen bestehen zwischen zwei Metallen, während ionische Bindungen zwischen Nichtmetallen und Metall beobachtet werden.
- Kovalente Bindungen beinhalten das Teilen von Elektronen in der Valenzschale, metallische Bindungen sind die Anziehungskraft zwischen den im Gitter der Metalle vorhandenen delokalisierten Elektronen, und Ionenbindungen werden als Übertragung und Akzeptanz von Elektronen von der Valenzschale bezeichnet.
- Die Leitfähigkeit ist bei kovalenten und ionischen Bindungen gering, bei metallischen Bindungen jedoch hoch.
- Kovalente Bindungen sind nicht sehr hart, obwohl Ausnahmen Silizium, Diamant und Kohlenstoff sind, selbst die metallischen Bindungen sind nicht hart, aber Ionenbindungen sind aufgrund der kristallinen Natur hart.
- Die Schmelz- und Siedepunkte der kovalenten Bindung sind im Gegensatz zu den höheren Metall- und Ionenbindungen niedrig.
- Metallische Bindungen sind formbar und duktil, während kovalente Bindungen und ionische Bindungen nicht formbar und nicht duktil sind.
- Die Bindungsenergie ist bei kovalenten und ionischen Bindungen höher als bei metallischen Bindungen.
- Beispiele für kovalente Bindungen sind Diamant, Kohlenstoff, Siliciumdioxid, Wasserstoffgas, Wasser, Stickstoffgas usw., während Silber, Gold, Nickel, Kupfer, Eisen usw. Beispiele für metallische Bindungen und NaCl, BeO, LiF usw. sind. sind die Beispiele für die Ionenbindungen.
Ähnlichkeiten
- Sie alle haben die elektrostatische Kraft von Anziehungskräften, die die Bindungen stärker macht.
- Sie verbinden ein Atom mit einem anderen.
- Die Bindung zwischen den Atomen führt zu einer stabilen Verbindung.
- Alle drei Bindungsarten ergeben unterschiedliche Eigenschaften, dann die ursprünglichen Elemente.
Fazit
In diesem Inhalt haben wir die verschiedenen Arten starker Bindungen und ihre verschiedenen Eigenschaften untersucht, durch die sie sich voneinander unterscheiden. Obwohl sie auch gewisse Ähnlichkeiten haben. Das Studium dieser Bindungen ist wichtig, um sie zu identifizieren, und kann sie sorgfältig und wo immer nötig verwendet werden.